Le parcours des patients atteints de maladies inflammatoires chroniques de l’intestin (MICI) et de leurs familles après un diagnostic de rectocolite hémorragique ou de maladie de Crohn est difficile. Accepter le diagnostic, consulter tous les spécialistes nécessaires, effectuer les examens permettant de connaître l’étendue de la maladie ou attendre que le bon traitement soit adapté et mis en place, ne sont que quelques-uns des obstacles et des difficultés à surmonter. Définir et administrer le bon traitement est d’ailleurs précisément l’un des aspects les plus complexes auxquels le patient sera confronté.
Actualités
Aphérèse des granulocytes pour les patients atteints de rectocolite hémorragique
10 janvier 2023
Adacolumn

Prenons le cas de la rectocolite hémorragique, une pathologie responsable d’une inflammation du rectum et du côlon : le patient va souffrir de récidives avec des poussées plus ou moins intenses et plus ou moins longues. Les médicaments faisant actuellement partie de l’arsenal thérapeutique des professionnels de santé pour traiter les patients visent à induire la rémission de ces poussées et à maintenir les MICI inactives afin d’améliorer la qualité de vie du patient. Et, bien sûr, toujours avec un maximum d’efficacité et de sécurité.
Compte tenu du fait que certains patients ne répondent pas aux traitements conventionnels ou ne peuvent même pas les prendre en raison de leur profil, les professionnels de santé ont vu dans l’aphérèse des granulocytes (GMA) un allié thérapeutique avec des garanties de succès chez les patients atteints de rectocolite hémorragique. Cette technique réduit le nombre de cellules inflammatoires dans le sang sans qu’il soit nécessaire d’administrer un médicament au patient.
En quoi consiste l’aphérèse des granulocytes ?
Comme nous l’avons écrit précédemment, la GMA est un traitement non pharmacologique dont le principe consiste à faire passer le sang du patient à travers un dispositif de circulation extracorporelle afin d’en éliminer les composants pathogènes qui conditionnent ou perpétuent la maladie, contribuant ainsi au traitement.
L’un des systèmes d’aphérèse des granulocytes commercialisés en Europe se compose d’une colonne ou d’un filtre qui contient des sphères d’acétate de cellulose et permet l’adsorption sélective de 65 % des granulocytes, 55 % des monocytes/macrophages et 2 % des lymphocytes, les éliminant ainsi de la circulation sanguine.
La procédure consiste à extraire le sang de la veine ulnaire du patient. Celui-ci passe dans le circuit et la colonne d’adsorption où il est purifié, avant d’être réinjecté par la veine ulnaire controlatérale (voir la fig. 1 illustrant le processus).
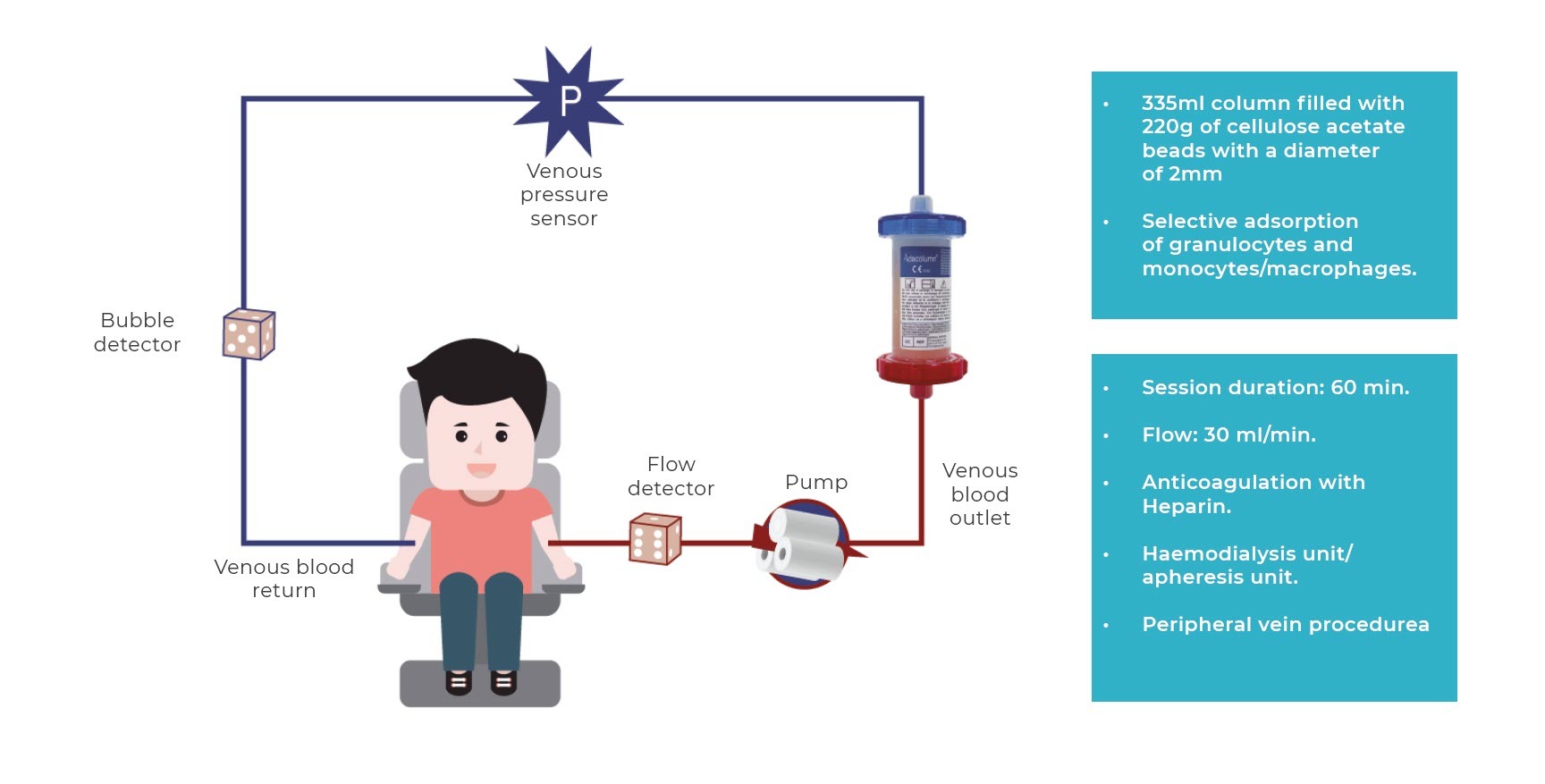
La procédure est réalisée dans des unités d’hémodialyse ou des banques de sang. Elle peut également être effectuée, après une formation adéquate, dans des services de traitement en ambulatoire. Le schéma d’application de la technique (fréquence et nombre de séances) varie de 5 à 10 séances (à raison de 1 ou 2 séances par semaine) d’une durée d’au moins 60 minutes, bien que la pratique clinique réelle dans la plupart des hôpitaux consiste en 10 séances (à raison de 2 séances/semaine les 3 premières semaines afin d’accélérer la réponse, puis de 1 séance par semaine jusqu’à la fin des 10 semaines) plus longues (généralement de 90 minutes), car ce schéma posologique s’est avéré sûr et bien toléré, obtenant de meilleurs résultats cliniques.
Cependant, la seule limite pratique à sa mise en œuvre est la difficulté d’accès et d’acheminement des cathéters veineux périphériques, qui peut nécessiter la mise en place d’un cathéter veineux central.
À l’heure actuelle, le mécanisme d’action exact de la GMA n’est pas encore connu. On sait cependant que les granulocytes et les monocytes/macrophages sont élevés et activés dans le sang périphérique dans de nombreuses maladies auto-immunes, que leur nombre est corrélé à l’activité et à la gravité de la maladie, et qu’ils jouent un rôle clé dans l’immunopathogenèse car ils produisent des quantités élevées de cytokines pro-inflammatoires responsables de lésions tissulaires.
L’une des hypothèses serait que le principal mécanisme d’adsorption de la GMA est lié à l’activation de la cascade du système du complément et entraîne l’adhérence des granulocytes à la colonne. Les leucocytes exprimant le récepteur Fc gamma (FcγR) et les récepteurs du complément (Mac-1, CD11b/CD18) adhèrent aux billes d’acétate de cellulose par activation du complément. Ainsi, la diminution du réservoir de granulocytes activés dans la circulation systémique est compensée par la mobilisation, depuis la moelle osseuse vers la circulation sanguine, de jeunes granulocytes non activés (CD10–), incapables de migrer vers le foyer inflammatoire.
De la même manière, il se produit un changement fonctionnel dans les monocytes activés qui expriment les marqueurs CD14+CD16+, ce qui dans son ensemble conduit à une diminution de la production de cytokines pro-inflammatoires et à une augmentation des médiateurs de l’inflammation en circulation ; en d’autres termes, il s’agit d’un phénomène d’immunomodulation et par conséquent d’une réduction de l’infiltrat inflammatoire et des lésions tissulaires.
La conséquence directe de l’élimination des leucocytes du système circulatoire est la mobilisation par la moelle osseuse de jeunes leucocytes inactivés, incapables de migrer vers le foyer inflammatoire. Et en plus de réduire le nombre total de cellules inflammatoires dans le sang, le passage de celui-ci dans la colonne modifie également la surface des cellules qui retournent dans le corps, induisant une série de changements au niveau immunitaire qui favorisent l’activation des mécanismes anti-inflammatoires inhibés, déclenchant alors l’inhibition de l’inflammation. En plus de produire une immunomodulation (un changement survenant dans le système immunitaire), l’inflammation et les lésions tissulaires (des cellules) de la muqueuse intestinale sont réduites.
Pour quels patients l’utilisation de la GMA est-elle indiquée ?
Il existe actuellement un arsenal thérapeutique très important pour le traitement des MICI, bien que ces médicaments soient inefficaces ou aient des effets indésirables chez certains patients.2 Par conséquent, d’autres options thérapeutiques sont nécessaires pour contrôler la progression de la maladie et éviter les interventions chirurgicales. La GMA est donc une alternative thérapeutique envisageable dans certains scénarios. Cette technique peut être appliquée dans différentes situations, y compris celles où les patients ne répondent pas de manière adéquate aux traitements pharmacologiques conventionnels ou développent une corticodépendance, en prévention des récidives et lorsque l’initiation d’un traitement immunosuppresseur ou une biothérapie est envisagée3,4.
Même si l’on recherche toujours le meilleur traitement pour chaque cas, il existe un pourcentage élevé de patients atteints de rectocolite hémorragique qui ne répondent pas aux traitements conventionnels, qu’ils soient à base de corticoïdes ou de thiopurine (un immunomodulateur) (Ardizzone et al, 2006) ou qu’il s’agisse d’un traitement par anti-TNF. Jusqu’à il y a quelques années, lorsqu’un professionnel de la santé se retrouvait face à une situation où les médicaments n’amélioraient pas l’état du patient, l’option la plus utilisée pour le traiter et améliorer sa qualité de vie était la chirurgie.
Mais au cours des dernières décennies, d’autres alternatives thérapeutiques plus sûres comme la GMA sont apparues pour les patients atteints de rectocolite hémorragique. Elles peuvent être appliquées aux patients suivants1:
- Patients adultes corticodépendants atteints de rectocolite hémorragique après l’échec, l’intolérance ou un risque élevé associé aux traitements immunomodulateurs et/ou biothérapies2.
- Patients âgés avec comorbidités.
- Patientes enceintes.
- Patients pédiatriques atteints de rectocolite hémorragique.
Contre-indications :
- Allergie à l’héparine et thrombopénie induite par l’héparine
- Numération des granulocytes inférieure à 2 000 /MI
- Anémia significative (Hb < 8 g/dl)
- Coagulopathie grave
- Infection active
- Cardiopathie ou néphropathie grave
Précautions :
Prudence en cas d’hypercoagulabilité (fibrinogène > 700 mg/ml) ou de déshydratation (diarrhée ou états fébriles récents). Ces facteurs doivent être corrigés au préalable.
GMA, un signe de sécurité et d’efficacité dans le traitement de la RH
S’il y a deux caractéristiques qui définissent la GMA, ce sont sa sûreté et son efficacité. Selon le projet Prodiggest3, cette option thérapeutique a fait l’objet d’études et de méta-analyses afin de pouvoir être qualifiée d’alternative efficace et sûre pour les patients.
D’une part, la GMA est décrite comme très sûre pour les patients atteints de rectocolite hémorragique car les effets indésirables des traitements conventionnels disparaissent. Les effets secondaires de la GMA sont pour la plupart légers et temporaires, le patient peut donc poursuivre le traitement. Il s’agit notamment de maux de tête, de frissons, d’une légère fièvre, de nausées, de fatigue, de myalgies, de palpitations, d’hypotension ou de rougeurs. Dans de nombreux cas, les effets indésirables sont davantage liés à la technique d’aphérèse qu’au traitement par GMA lui-même (problèmes de voies, etc.), d’où l’importance qu’il soit réalisé par des professionnels expérimentés.
D’autre part, en plus de son efficacité chez les patients pédiatriques, les femmes enceintes, les personnes âgées ou les patients corticodépendants et corticorésistants, il existe d’autres scénarios dans lesquels la GMA est efficace. Comme indiqué dans le projet Prodiggest, elle peut être utilisée en traitement de première intention avec un taux d’induction de rémission de 70 % face à une rectocolite hémorragique distale d’activité légère à modérée (Yamamoto et al 2004) et jusqu’à 80 % chez les patients dont la maladie a peu évolué et naïfs de corticoïdes (Takemoto et al 2007).
De plus, c’est une option qui peut prévenir la récidive dans certains cas de patients à haut risque de poussées récurrentes difficiles à contrôler. En ce sens, il est possible d’établir une durée moyenne de rémission clinique obtenue après une GMA de 10 mois chez les patients atteints de rectocolite hémorragique (Ljung et al 2007), voire d’un an si la maladie a été prise en charge tôt ou que peu de traitements ont été administrés au patient avant la GMA (corticoïdes, thiopurines, biothérapie, etc.).
- https://www.aegastro.es/publicaciones/publicaciones-aeg/protocolos-asistenciasles-prodiggest/uso-racional-de-la-granulocitomonoaferesis-en-la-enfermedad-inflamatoria-intestinal
- Traitement de la rectocolite hémorragique chez les patients corticodépendants et en échec des biologiques : Adacolumn – Adacyte
- https://www.aegastro.es/publicaciones/publicaciones-aeg/protocolos-asistenciasles-prodiggest/uso-racional-de-la-granulocitomonoaferesis-en-la-enfermedad-inflamatoria-intestinal
- Dignass A, Lindsay JO, Sturm A, Windsor A, Colombel JF, AllezM, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: Currentmanagement. J Crohns Colitis. 2012;6:991—1030.
- Dignass A, Akbar A, Hart A, et al. Safety and efficacy of granulocyte/monocyte apheresis in steroid-dependent active ulcerative colitis with insufficient responseor intolerance to immunosuppressants and/or biologics [the ART trial]: 12-week interim results. J Crohns Colitis. 2016;10:812–820.
- Dittrich K, Richter M, Rascher W, et al. Leukocytapheresis in a girl with severe ulcerative colitis refractory to corticosteroids, infliximab, and cyclosporine A. Inflamm Bowel Dis. 2008;14:1466–1467.
Contactez-nousPour en savoir plus
Contactez-nous

